Een overzicht van efficiëntietesten van desinfectieproducten - De relevantie van een natte contacttijd

Inleiding
Het gebruik van desinfectiemiddelen om microbiële verontreiniging in een omgeving onder controle te houden is vastgelegd en wordt geregeld door toezichthoudende instanties in zowel Europa als de Verenigde Staten.
De Verordening Biocide Producten (Biocidal Products Regulation 528/2012 [1] - BPR) betreft de marketing en het gebruik van biocide producten in Europa. Chemische desinfectiemiddelen in de Verenigde Staten worden geregistreerd en gereguleerd door de Amerikaanse Environmental Protection Agency (EPA) onder de Federale Akte voor insecticide, fungicide en rodenticide (Federal Insecticide, Fungicide and Rodenticide Act - FIFRA) (40 CFR delen 150-189) [2]. Desinfectiemiddelen worden onder de FIFRA beschouwd als 'antimicrobiële pesticiden'.
Voor de registratie van een desinfectiemiddel wordt de fabrikant door BPR of EPA verplicht gegevens te verstrekken die de efficiëntie van een desinfectiemiddel (bactericide, fungicide, sporicide of viricide) aantonen.
Volgens de regelgeving moeten ook de eindgebruikers van desinfectiemiddelen binnen de farmaceutische sector de efficiëntie van het desinfectiemiddel aantonen. De richtlijn van de Amerikaanse Food and Drug Administration (FDA) voor de farmaceutische industrie zegt: "De geschiktheid, efficiëntie en beperkingen van desinfectiemiddelen en- procedures moeten worden beoordeeld. De werkzaamheid van deze desinfectiemiddelen en -procedures dienen te worden gemeten aan de hand van hun vermogen om te garanderen dat potentiële verontreinigingen op adequate wijze worden verwijderd van oppervlakken" [3]. Binnen Europa worden vergelijkbare vereisten gesteld door de Europese Commissie "4.37 Het desinfectieproces moet worden gevalideerd. Validatie-onderzoeken moeten de geschiktheid en effeciëntie van desinfectiemiddelen aantonen op de specifieke manier waarop zij worden gebruikt en moeten de vervaltermijnen van de bereide oplossingen ondersteunen." [4].
Methodes om efficiëntie aan te tonen
In Europa verstrekt de European Norm (EN) standaard 14885: 2018 [5] de referenties voor de vereiste testmethodes (EN-standaards) die door de fabrikanten van desinfectiemiddelen moeten worden gebruikt om de claims van microbiële activiteit te ondersteunen. In de Verenigde Staten geeft de EPA-richtlijn voor productprestatietesten OCSPP 810.2100 [6] aan welke testmethodes (methodes van de Association of Official Analytical Chemists (AOAC)) moeten worden gebruikt door fabrikanten van desinfectiemiddelen om de microbiële activiteit te kunnen claimen.
De soorten testen kunnen worden opgesplitst in twee categorieén:
- Suspensietesten
bijv. EN 1276 Chemische desinfectiemiddelen en antiseptica. Kwantitatieve suspensietest voor de evaluatie van bactericide activiteit van chemische desinfectiemiddelen en antiseptica in voeding, en op industriel, huishoudelijk en institutioneel gebied. Testmethode en vereisten (fase 2, stap 1).
EN 1650 Chemische desinfectiemiddelen en antiseptica. Kwantitatieve suspensietest voor de evaluatie van fungicide activiteit van chemische desinfectiemiddelen en antiseptica in voeding, en op industriel, huishoudelijk en institutioneel gebied. Testmethode en vereisten (fase 2, stap 1).
AOAC Officiële methode 955.15 Testen van desinfectiemiddelen tegen staphylococcus aureus, verdunningsmethode.
- Oppervlaktetesten
bijv. EN 13697 Chemische desinfectiemiddelen en antiseptica - Kwantitatieve niet-poreuze oppervlaktetest voor de evaluatie van bactericide en/of fungicide activiteit van chemische desinfectiemiddelen in voeding, en op industriel, huishoudelijk en institutioneel gebied. Testmethode en vereisten zonder meechanische actie (fase 2, stap 2).
AOAC Officiële methode 961.02 Kiemdodende sprayproducten als desinfectiemiddelen
De verschillende testmethodes gebruiken specifieke startinoculum, organismen, logreducties en contacttijden.
Voor desinfectieclaims binnen Europa maken fabrikanten van desinfectiemiddelen meestal gebruik van de EN-testen. De EN-testnummers kunnen dan worden vermeld op de productlabels, samen met de standaard contacttijden die in de methode worden aangegeven. De standaard testmethodes worden meestal gebruikt omdat ze degelijk, herhaalbaar en overal erkend zijn. Het kan voor eindgebruikers nuttig zijn om resultaten van standaard testmethodes te kunnen raadplegen, zodat ze producten van verschillende fabrikanten kunnen vergelijken.
Het kan echter voorkomen dat de standaard testmethodes niet de omstandigheden van de farmaceutische cleanroom van een eindgebruiker van een desifectiemiddel weerspiegelt. Eindgebruikers hebben meestal andere oppervlaktematerialen in hun cleanrooms, andere aanwezige micro-organismen en andere omgevingsfactoren (zoals lage vochtigheidsgraad, snelle droogtijd vanwege luchtbehandelingssystemen).
De United States Pharmacopoeia (USP) hoofdstuk <1072> [7] geeft verdergaand advies over het efficiënt testen voor de farmaceutische sector: "Om de efficiëntie van een desinfectiemiddel aan te tonen binnen een farmaceutische productie-omgeving, kan het nodig zijn om de volgende testen uit te voeren: (1) verdunningstesten (testen van desinfectiemiddelen op hun efficiëntie bij verschillende concentraties en contacttijden tegen een breed spectrum van testorganismen en omgevingsisolaten); (2) desinfectie-oppervlaktetesten (met gebruik van standaard testorganismen en micro-organismen die typische omgevingsisolaten zijn, door desinfectiemiddelen toe te passen op oppervlakken met de geselecteerde gebruiksconcentratie en een specifieke contacttijd, en de logreductie van de gespecificeerde micro-organismen te bepalen); en (3) een statistische vergelijking van de isolatiefrequentie van geïsoleerde micro-organismen voor en na de toepassing van een nieuw desinfectiemiddel.
Dit wordt noodzakelijk geacht omdat essentiële stappen in het proces als het desinfecteren van aseptische verwerkingszones, zoals dit wordt vereist door de GMP-regelgeving, moeten worden gevalideerd en de registratievereisten van de EPA geven niet aan hoe desinfectiemiddelen werkellijk worden gebruikt in de farmaceutische, biotechnologische en medische instrumentensectoren.
In lijn met de USP-richtlijn is het relatief gemakkelijk om verschillende micro-organismen en testoppervlakken te gebruiken met standaard testmethodes. Het bereiken van de gespecificeerde contacttijd met de standaard testmethodes kan echter een uitdaging zijn binnen de omgevingsfactoren van een farmaceutische cleanroom. De verdampingssnelheid van een desinfectiemiddel dat op een oppervlak is aangebracht in een cleanroom met een hoge luchtwisselingssnelheid kan aanzienlijk verschillen van de verdampingssnelheid in laboratoriumomstandigheden. Dit roept de vraag op of het oppervlak voor de werkzaamheid van het desinfectiemiddel gedurende de gespecificeerde tijd zichtbaar nat moet zijn en wat precies bedoeld wordt met contacttijd.
Definitie van contacttijd
Om te bepalen of het een vereiste van de farmaceutische sector is dat de oppervlakken zichtbaar nat moeten zijn gedurende te contacttijd (hierna: "natte contacttijd") heeft er een herziening plaatsgevonden van de regelgeving.
De richtlijnen van de VS [3],[8], EU GMP [4] en het farmaceutische inspectiesamenwerkingsprogramma [9] geven geen definitie van 'contacttijd'. De European Pharmacopoeia (EP) geeft geen richtlijn voor efficiëntietesten van desinfectiemiddelen. Daarentegen gebruikt USP, paragraaf 1072 [7], de term 'contacttijd' frequent, maar geeft het geen uitleg over de betekenis in de paragraaf met definities. De ISO-norm voor cleanrooms (ISO 14644 deel 5 [10]) geeft ook geen definitie.
Omdat de regelgevingen van de farmaceutische sector geen duidelijke definitie geven, is er een breder onderzoek naar andere toepasselijke regelgevende documenten en erkende richtlijnen in de farmaceutische industrie uitgevoerd.
Royal Pharmaceutical Society/NHS Pharmaceutical Quality Assurance Committee geeft richtlijnen voor de toepassing van desinfectiemiddelen, en geeft aan dat "overmatige hoeveelheden van reinigings- en desinfectiemiddelen moeten worden voorkomen. Idealiter moeten oppervlakken binnen 1 uur na toepassing opgedroogd zijn. Daarentegen dient er voldoende product achter te blijven voor de vereiste werkzaamheid gedurende de aanbevolen contacttijd, d.w.z. desinfectiemiddelen mogen niet te karig worden aangebracht." [11]. Deze verklaring concludeert dat voor een werkzaam product een natte contacttijd noodzakelijk is.
De EN- en AOAC-methodes spreken niet van een 'natte contacttijd'. In suspensietesten wordt altijd gebruik gemaakt van een 'natte contacttijd' omdat de test bestaat uit het toevoegen van het desinfecterende product aan een organismesuspensie dat gedurende de vereiste contacttijd in een oplossing wordt gehouden met aan het einde van deze contacttijd een productneutralisator.
Dit is echter niet zo duidelijk voor oppervlaktetesten, daar een hoeveelheid desinfectiemiddel, zoals gedefinieerd door de norm, met een pipet op een oppervlak wordt gedeponeerd zonder het uit te spreiden. Vanwege de kleine hoeveelheid die gepipetteerd wordt en de relatief hoge oppervlaktespanning van de meeste geteste desinfectiemiddelen, is het waarschijnlijk dat een natte contacttijd wordt bereikt onder laboratoriumomstandigheden.
De EN-oppervlaktetest met mechanische actie, EN 16615 [12], biedt een testmethode die het dichtst bij het praktische gebruik van desinfectiemiddelen komt, omdat deze de actie van het aanbrengen van het desinfectiemiddel op een oppervlak heeft opgenomen. In de paragraaf Omstandigheden van het experiment wordt de volgende informatie gegeven met betrekking tot de contacttijd: "De contacttijd voor oppervlaktedesinfectiemiddelen wordt gekozen op basis van de praktische omstandigheden van het product. De aanbevolen contacttijd voor het gebruik van het product is de verantwoordelijkheid van de fabrikant." Uit de verwoording "praktische omstandigheden van het product" kan worden afgeleid dat zij refereren aan hoeveelheden die worden toegepast door dweilen of vegen en de verdampingssnelheden, bijvoorbeeld door alcohol te vergelijken met een quartaire ammoniumverbinding, maar nogmaals, dit is geen duidelijke definitie.
De Pharmaceutical and Healthcare Sciences Society (PHSS) Technical Monograph 20 geeft in paragraaf 3.3.4 de volgende informatie: "De coupons zijn blootgesteld aan een desinfectiemiddel gedurende de gedefinieerde natte contacttijd / verblijftijd" [13]. Dit is een duidelijke aanduiding dat de contacttijd nat is.
De richtlijn van het Amerikaanse Center for Disease Control and Prevention (CDC) [14] geeft de volgende definitie van contacttijd: "Tijd dat een desinfectiemiddel in direct contact is met het oppervlak of item dat gedesinfecteerd moet worden. Voor de desinfectie van een oppervlak wordt deze tijd afgebakend door het aanbrengen op het oppervlak totdat het product volledig is opgedroogd." Deze definitie geeft ook duidelijk een natte contacttijd aan.
De richtlijn productprestatietest OCSPP 810.2000 [15], geeft de volgende informatie over contacttijd: "De contacttijd die gebruikt wordt bij efficiëntietesten moet gelijk zijn aan of korter zijn dan de contacttijd die op het productlabel vermeld staat. Als een andere contacttijd dan die van het bereik dat geïdentificeerd wordt in de testmethode of richtlijn gewenst is, wordt aanbevolen vóór het testen het agentschap te raadplegen daar een wijziging van de standaard benadering noodzakelijk kan zijn. In de meeste gevallen wordt een modificatie om een langere blootstellingstijd te gebruiken beperkt door de praktische overwegingen van het gebruikspatroon (bijv. een blootstellingstijd van >10 minuten voor een product dat waarschijnlijk binnen 10 minuten van het behandelde oppervlak zal verdampen). Geef een duidelijke identificatie en rechtvaardiging van alle modificaties van methodes in het testprotocol. Wanneer het product wordt toegepast op een hard niet-poreus oppervlak kan voor vloeibare of sprayproducten met volatiele actieve ingrediënten de maximale contacttijd worden bepaald door het visueel inspecteren van de verdamping gedurende de voorgestelde contacttijd." Ook deze verklaring geeft duidelijk de verwachting van een natte contacttijd aan.
Het technische rapport van PDA 70 [16] geeft de volgende definitie: "De minimale duur dat een ontsmettingmiddel, desinfectiemiddel of sporicide in volledig (nat) contact is met het te behandelen oppervlak om werkzaam te zijn". Deze definitie geeft duidelijk aan dat het gaat om natte contacttijd.
De handleiding van Pharmig voor het gebruik van desinfectiemiddelen [17] geeft de volgende tekst: "Het desinfectiemiddel kan sneller verdampen op warme oppervlakken of wanneer het behandelde oppervlak zich in omstandigheden van lage luchtvochtigheid of hoge luchtwisselingssnelheid bevindt, zoals soms het geval is bij behandelingen in cleanrooms." Deze verklaring concludeert dat voor een werkzaam product een natte contacttijd noodzakelijk is.
Uit het bovenstaand overzicht van publicaties van gerespecteerde farmaceutische instanties wordt duidelijk dat de contacttijd nat dient te zijn.
Het is niet ondenkbaar dat het desinfectiemiddel effectief blijft nadat het oppervlak zichtbaar droog is, daar de actie plaatsvindt op cellulair niveau. De eerste fase van het doden van microben is de opname van het actieve ingrediënt van het desinfecterende middel door de cel. Daarom kan worden overwogen dat er twee "tijden" zijn tijdens de desinfectie (figuur 1).
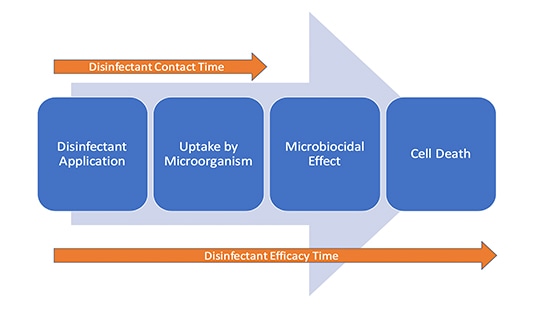
Conclusie
Om de werkzaamheid aan te tonen moet de leverancier van een desinfectiemiddel een aantal standaard testen uitvoeren in herhaalbare omstandigheden waarmee een contacttijd wordt bepaald. Deze contacttijd kan nuttig zijn voor de eindgebruiker bij het selecteren van het desinfectiemiddel.
Een eindgebruiker moet de werkzaamheid van het desinfectiemiddel ook valideren en de gebruiksomstandigheden binnen de faciliteit weergeven, zoals het bepalen van een contacttijd die in de praktijk wordt aangehouden.
De meeste organisaties die farmaceutische adviezen geven definiëren contacttijd als een natte contacttijd.
Er zijn slechts enkele studies gepubliceerd die de prestaties van desinfectiemiddelen onderzoeken nadat de oppervlakken zichtbaar droog waren. Het is daarbij in de praktijk ook onmogelijk dit te meten, daar de gebruiker de celdood als eindpunt niet kan waarnemen.
Om de testen voor de eindgebruiker te vergemakkelijk, zodat het representatief is voor de gebruikte faciliteitsomstandigheden, wordt aangeraden om de tijd te meten die het desinfectiemiddel nodig heeft om te verdampen wanneer het wordt aangebracht met routinetechnieken (vegen/dweilen) en deze contacttijd te gebruiken voor laboratoriumstudies.
Referenties:
- Verordening (EU) nr. 528/2012 van het Europese Parlement en van de Raad van 22 mei 2012 betreffende het beschikbaar stellen op de markt en het gebruik van biocide producten.
- Titel 40 van de Code of Federal Regulations (40 CFR), subparagraaf E: Pesticide programma's, deel 150-189
- FDA Guidance for Industry - Steriele medicinale producten geproduceerd door aseptische verwerking. Huidige Good Manufacturing Practice (2004)
- EudraLex Volume 4 EU-richtlijnen voor Good Manufacturing Practice van medicinale producten voor menselijk en dierlijk gebruik. Bijlage 1: Productie van steriele medicinale producten (Conceptbijlage v. 12 van februari 2020)
- EN 14885:2018 - Chemische desinfectiemiddelen en anticeptica. Toepassing van Europese normen voor chemische desinfectiemiddelen en antiseptica
- EPA Product Performance Test Guideline, OCSPP 810.2100 - Sterilisatiemiddelen, sporiciden en decontaminanten. Handleiding voor efficiëntietesten. [EPA 712-C-17-003]
- United States Pharmacopoeia (USP), paragraaf 1072 - Desinfectiemiddelen en antiseptica
- The Code of Federal Regulations CFR. Titel 21 - Voeding en geneesmiddelen: deel 1 tot 1499
- PICS HANDLEIDING VOOR GOOD MANUFACTURING PRACTICE VAN MEDICINALE PRODUCTEN, BIJLAGEN PE 009-14
- ISO 14644, deel 5 - Cleanrooms en bijbehorende gecontroleerde omgevingen - Deel 5: Handelingen, 2004
- Royal Pharmaceutical Society. Kwaliteitsgarantie van aseptische bereidingsdiensten: normen. Deel A 5e editie 2016
- EN 16615 - Chemische desinfectiemiddelen en antiseptica - Kwantitatieve testmethode voor de evaluatie van bactericide en gistdodende activiteit op niet-poreuze oppervlakken met mechanische actie door gebruik van doeken in de medische zones (4-voudige test) - Testmethode en vereisten (fase 2, stap 2)
- Pharmaceutical and Healthcare Sciences Society (PHSS) Technical Monograph 20 - Typering, controle, toezicht en afwijkingenbeheer van biocontaminatie in gecontroleerde/GMP-klasse zones
- Center for Disease Control and Prevention (CDC) - Handleiding voor desinfecteren en steriliseren in zorginstellingen (2008)
- Product Performance Test Guideline, OCSPP 810.2000, Algemene overwegingen voor het testen van antimicrobiële pesticide in de openbare gezondheidszorg. Handleiding voor efficiëntietesten. [EPA 712-C-17-002]
- Parenteral Drug Association (PDA) - Technisch rapport nr. 70. De fundamenten van reinigings- en desinfectieprogramma's voor aseptische productiefaciliteiten (2015).
- Pharmig - Handleiding voor desinfectiemiddelen en hun gebruik in de farmaceutische industrie (2017)
- West AM, Teska, PJ, Oliver HF - Er is geen bactericide werking meer van bij Environmental Protection Agency geregistreerde desinfectiedoekjes nadat het oppervlak is opgedroogd of na de contacttijd die op het label staat vermeld. Am J Infect Control 2019; 47: 27-32.



