Visueel schoon: duidelijkheid brengen in regelgevende richtlijnen
Door Thomas Altmann, Global CIP/COP Technical Manager Cleaning Validation

Visueel schoon is een term die wordt gebruikt in bijna alle farmaceutische regelgeving (FDA, PIC/S, GMP). Eenvoudig gezegd; equipment die wordt gebruikt in farmaceutische fabrieken moet worden geïnspecteerd op visuele properheid voorafgaand aan het gebruik1.
Dit klinkt heel logisch - maar slechts weinig weten met 100% zekerheid wat visueel proper inhoudt in standaard bedrijfsprocedures en hoe dit moet worden gedocumenteerd voor reinigingsvalidatie. De meest gestelde vragen zijn:
- Hoe zien residuen eruit?
- Wat is de visuele drempel?
- Hoe beïnvloedt het constructiemateriaal de zichtbaarheid?
- Hoe vaak moet het zicht van een inspecteur worden getest?
Hieronder vindt u een korte uiteenzetting voor deze problemen.
Hoe zien residuen eruit?
Uw inspecteurs moeten weten waar ze naar zoeken tijdens het inspecteren van equipment. Ze moeten op zijn minst het verschil kunnen zien tussen procesresiduen en residuen die zijn achtergebleven door detergenten en ontsmettingsproducten - en hoe laag het niveau van elk soort residu moet zijn dat wordt aangetroffen. Als aanvulling moeten inspecteurs kennis hebben over hoe een visueel proper oppervlak eruitziet, inclusief de kleuring van staal, krassen of andere beschadigingen die geen invloed hebben op de volgende productiestap.
Active Pharmaceutical Ingredients (API) verschijnen bijvoorbeeld vaak als poeders en residuen van reinigingsproduct kunnen worden aangetroffen als vlekken op het oppervlak.

API-residuen verschijnen vaak als poeders.

Residuen van reinigingsproducten verschijnen vaak als vlekken.
Residuen van reinigingsproducten worden vaak gemist door de 'visueel proper'-inspecteurs. Farmaceutische fabrikanten die reinigingsproducten gebruiken voor voedsel- en drankentoepassingen moeten zich ervan bewust zijn dat residuen van niet in water oplosbare ingrediënten zoals corrosieremmers of specifieke oppervlakteactieve stoffen kunnen achterblijven en een onverwachte interactie veroorzaken met residuen van API's en kunnen worden overgedragen naar het product wat daarna wordt geproduceerd.
Hoe beïnvloedt het constructiemateriaal de zichtbaarheid?
Residuen kunnen er anders uitzien afhankelijk van het materiaal dat is gebruikt om de geïnspecteerde equipment te maken. Grofweg 90% van de equipment die wordt gebruikt in farmaceutische fabrieken is gemaakt van roestvrij staal - en glas, rubber en polymeren zoals teflon en EPDM voor het grootste deel van de rest.
Bij het selecteren van equipment en opleiden van inspecteurs moet er rekening mee worden gehouden dat het spotten van residuen op polymeer oppervlakken moeilijker is dan het spotten van residuen op equipment die is gemaakt van roestvrij staal.
Equipment van roestvrij staal dat wordt blootgesteld aan hitte kan/zal na verloop van tijd echter verkleuren, waardoor het moeilijker wordt om residuen te identificeren dan toen de equipment werd geleverd. Elk bekrast oppervlak van equipment zal opnieuw gepolijst (indien mogelijk) of vervangen moeten worden zodra 'visueel proper' niet langer veilig kan worden geverifieerd.

Inspecteurs moeten worden opgeleid om te kunnen zien hoe elk soort residu op elk soort oppervlak verschijnt.

De verschijning van residu kan worden beïnvloed door verschillende materialen (roestvrij staal versus teflon of nieuw/gepolijst versus verkleurd roestvrij staal).
Wat is de visuele drempel?
De visuele drempel is het concentratieniveau waarbij een API of residu zichtbaar wordt. Fabrikanten moeten de visuele drempel vaststellen voor elke API of residu - en daarna vergelijken met het niveau waarop diezelfde API of residu toxicologisch aanzienlijk wordt. Als de visuele drempel lager is dan het vooraf vastgestelde toxicologische aanzienlijke niveau voor diezelfde API of reinigingsresidu, dan is visueel proper een geldige maatstaaf.
De analyse hieronder toont de concentratie waarbij paracetamol (een API met een relatief laag risico) zichtbaar wordt.
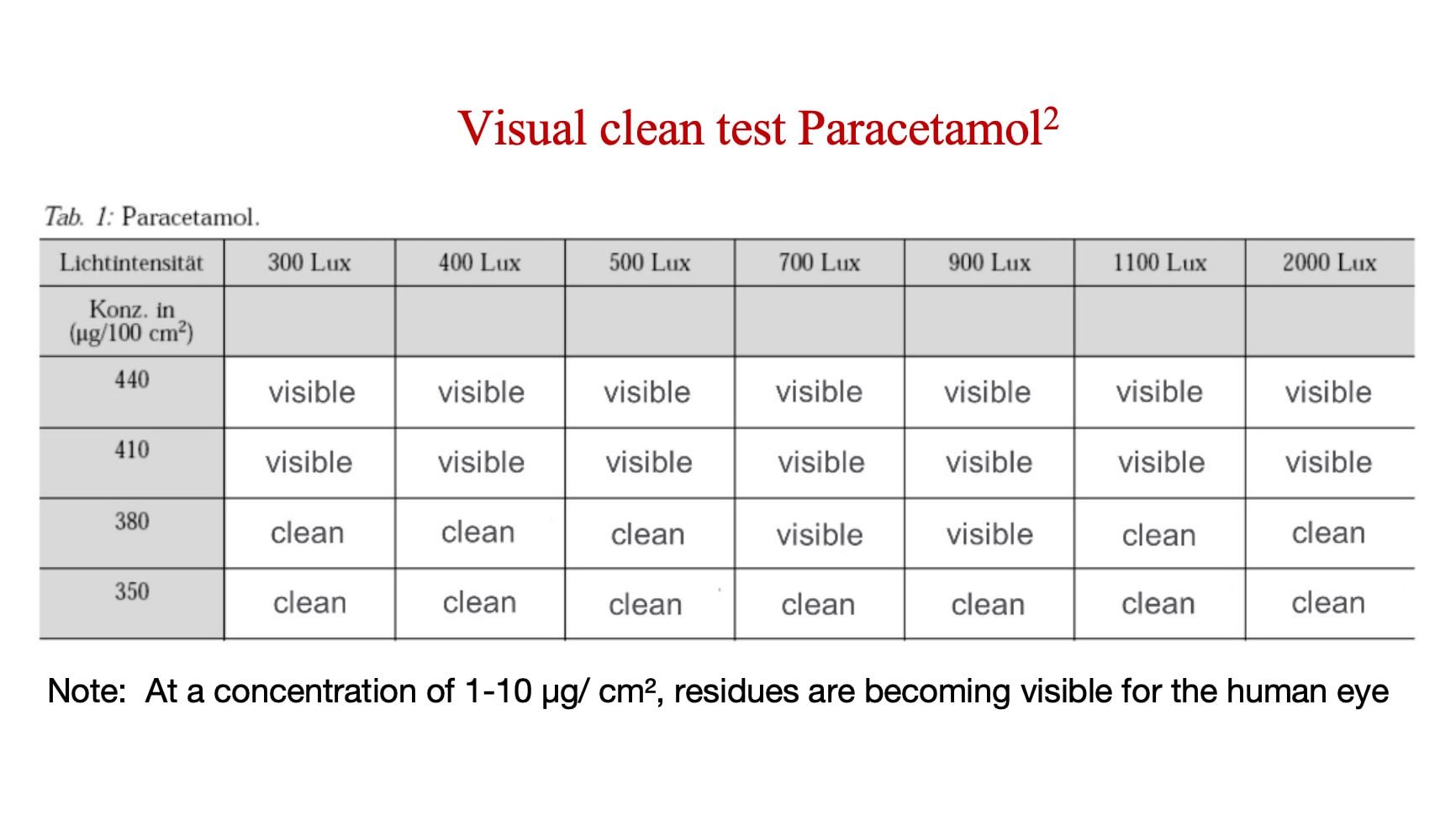
Hoe vaak moet het zicht van een inspecteur worden getest?
Nogmaals, de richtlijnen zijn niet specifiek. Veel bedrijven vereisen nu dat alle operators die visuele inspecties uitvoeren elk jaar een oogtest moeten laten afnemen.
Dit is niet door de wet verplicht. Aan de andere kant, als uw reinigingsprocedures in het geding komen, dan zal de onderbouwing dat u uw inspecteurs grondige training biedt en regelmatig het zicht van de inspecteurs laat testen zeker helpen bij het overtuigen van de regelgevende instanties dat u alles heeft gedaan wat redelijkerwijs van u kan worden verwacht.
Heeft u nog vragen?
Neem voor meer informatie over beste praktijken en richtlijnen voor visueel proper contact op met Ecolab Life Sciences. We zijn aanwezig op farmaceutische locaties over de hele wereld en kunnen inzichten bieden in hoe andere fabrikanten visueel proper hebben geïmplementeerd in hun reinigingsvalidatieprogramma's.
1FDA - 21 CFR Part 211.67 vereist in punt (6) Inspectie van equipment voor properheid direct voor gebruik
2Pharm. Ind. 62, Nr. 6 (2000) Buscalferri et al. − Reinigungsvalidierung


